
2月10日,伦敦学院的一名博士在研究新冠肺炎疫苗,他手里拿着的是新冠肺炎病毒样本
简单的牛痘与复杂的疫苗
牛痘疫苗的出现,把人类惯坏了。
全世界公认的第一款牛痘疫苗是由英国医生爱德华·詹纳(Edward Jenner)在18世纪末期发明的,距今已有200多年的历史了。根据古籍记载,中国人甚至早在宋朝时就已经开始尝试用牛痘来防天花了,比詹纳还要早很多年。这两件事让不少人产生了错觉,以为疫苗很容易制造。你想啊,老祖宗连什么是免疫系统都不知道,就已经发明出了牛痘疫苗,为什么今天的人类还要等那么久呢?没有道理嘛!
一个简单的解释是:老祖宗们太幸运了!牛痘疫苗的出现是各种巧合的结果,古人只要胆子大就可以了。可惜的是,这样的巧合在历史上只出现过那么一次,后来的人类就没有这么好的运气了。所以我们必须先努力把疫苗的作用机理搞清楚,才能制造出像牛痘这么好用的疫苗。
疫苗的原理说起来并不复杂,它利用了人体免疫系统的记忆功能,通过接种的办法让免疫系统误以为自己正在受到某种病原体的攻击,从而记住这个病原体的样子,并对未来可能发生的同类型感染做好准备。这就好比一个国家事先找几个演员穿上敌军士兵的服装搞一次国防军事演习,道理是一样的。
问题在于,要想让免疫系统形成记忆是需要很多先决条件的,这些条件为疫苗的研发制造了很多困难。下面就以病毒为例,解释一下这些条件如何影响了疫苗的制造。

3月23日,德国慕尼黑大学医院的医务人员为抗疫一线工作者提取鼻子和喉咙黏膜的样本,用来检测是否感染新冠病毒
首先,病毒必须始终维持基本的样貌,否则免疫系统的记忆力就没有用武之地了。艾滋病疫苗之所以至今未能研制成功,流感疫苗之所以必须每年换一种型号,就是因为艾滋病毒和流感病毒的突变率太高所致。天花病毒是DNA病毒,突变率很低,所以牛痘疫苗取得了成功。新冠病毒虽然是RNA病毒,但它自带一个纠错系统,所以突变率也比较低,至今尚未出现任何足以改变病毒基本形态的基因突变。因此,起码从理论上说,新冠疫苗是可行的。
其次,用于接种的疫苗必须达到一定的量才能激活免疫系统的记忆功能,否则无效。传统疫苗通过两种不同的手段来达到这个目的,一个是灭活疫苗,一个是减活疫苗。两者各有千秋,但都已是非常成熟的技术了。
先说灭活疫苗。这个方法首先需要制备出大量活病毒,再用某种方式(比如甲醛)将其灭活(杀死),然后把病毒尸体(主要是蛋白质外壳)通过注射的方式引入健康人体内,希望它能激活免疫系统,使之产生足够强的记忆力。
因为接种的是死病毒,其蛋白质外壳很容易在人体内被降解掉,从而失去效力,所以灭活疫苗经常需要接种好几次,有时还必须添加一些佐剂来增加免疫反应的强度,操作起来非常复杂,对疫苗的需求量也相当大。
灭活疫苗的一个变种就是通过基因工程等方法直接在生物发酵罐里生产出病毒外壳上的某个蛋白质或者某个多糖分子,然后把这个大分子(或是两者的结合物)制备成疫苗进行接种。这样的大分子就是大名鼎鼎的抗原(Antigen),这是免疫反应的基本单位。
再说减活疫苗。这个方法首先需要找到一株和原来的病毒外观极其相似,但毒性却非常弱的病毒株,让它去感染人体,从而获得针对高毒性病毒株的免疫力。问题在于,像这样的低毒病毒株在自然界极其罕见,牛痘几乎是唯一的例外,所以说古人的运气实在是太好了。
科学家们没有古人那么好的运气,只能先想办法找到一种合适的动物宿主,用人工方式让其感染病毒,然后一代一代地进行筛选,希望能筛到一株像牛痘这样的弱病毒株。这个过程很花时间,还不一定能成功,风险很大。不过,一旦成功了,剩下的事情就好办多了,只要把这种减活病毒直接制成疫苗就可以了。接种过程相当于一次轻症感染,病毒会在人体内继续繁殖,持续对免疫系统形成刺激,所以通常只需接种一次就行了,对疫苗的需求量相对要小一些。
再次,疫苗毕竟只是一次对身体的“欺骗”,不是真的感染,所以即使人体对疫苗产生了免疫反应,生成了相应的抗体(Antibody),也不一定能起到保护作用,甚至可能反而有害,所以必须先进行大规模人体试验才能确定疫苗可用。
人体试验很费时间,但这一步绝不能省,否则会出事的。这方面的案例很多,比较有名的一次是1966年进行的合胞病毒(Syncytial Virus)疫苗人体试验。这个病毒能导致呼吸系统感染,早期临床试验显示该疫苗确实能够在受试者体内产生抗体,但大规模临床试验却导致一大批受试者病情加重,两名受试儿童因此死亡。后续研究发现,这个疫苗诱导出来的抗体虽然能与病毒表面蛋白相结合,但这种结合不但不能阻止其进入人体细胞,还会诱发一种被称为“免疫增强”(Immune Enhancement)的现象,反而加重了病情。
综上所述,免疫系统的这3个特征决定了疫苗研发是一项非常复杂的系统工程,每一步都需要耗费大量的时间和金钱。更重要的是,疫苗和药物不一样,后者是给病人吃的,安全性标准可以稍微降低一些,对产能的要求也不高。但预防性疫苗是给普通健康人用的,安全标准必须定得非常高才行,对产能的要求也是任何药物都没法相比的。
3月14日,委内瑞拉加拉加斯的一名护士正在给居民注射疫苗
就拿流感疫苗来说,目前常用的流感疫苗都是灭活疫苗,这个方法要求疫苗制造商能够廉价地生产出大量流感病毒,难度是很大的。所幸流感病毒能够在鸟类当中繁殖,所以疫苗制造商们从20世纪30年代开始尝试用鸡蛋来制备流感疫苗,取得了成功。根据美国疾控中心(CDC)的统计,去年全美国一共发放了1.745亿剂流感疫苗,82%都是通过鸡蛋的方式生产出来的。按照每个鸡蛋生产一个剂量计算,生产这批疫苗一共用掉了1.4亿个鸡蛋,而且还必须是受精卵,工作量相当大,所以相关部门都要提前半年开始生产,才能赶得上当年的流感季。
相比之下,新冠病毒无法在鸡蛋中繁殖,目前也没有找到其他更好的替代品,只能在培养的人体细胞中进行繁殖,不但产能提不上去,成本也很难降得下来。
由于以上原因,疫苗从研发到使用需要经历一个漫长的过程,通常至少要花10年的时间。目前的疫苗研发速度纪录是由埃博拉疫苗保持的,时间是5年。但这个纪录有点投机取巧的成分,因为埃博拉疫情早在1976年就在苏丹暴发了。那次疫情虽然没有持续下去,但后来在非洲又断断续续地出现过好几次,科学家早有准备,前期已经进行了大量基础研究,对这个病毒的基本特征已有所了解。所以,当2013年西非暴发大规模埃博拉疫情时,科学家们手里已经掌握了很多相关知识,对疫苗研发起了很大帮助。但即便如此,这个疫苗仍然直到2017年底才终于被批准上市,那时疫情已经过去一年了。
虽然没有派上用场,但埃博拉疫苗好歹算是研制出来了。“非典”(SARS)和中东呼吸综合征(MERS)疫苗的运气就惨多了,这两种传染病都只流行了很短的时间就被控制住了,所以两种疫苗的研发都没能完成I期临床试验就被迫中止,因为没人愿意再往里投钱了。
总之,现代医学虽然大大提高了疫苗的使用范围和效力,但有一个问题始终没能很好地解决,这就是时间。所以现在的疫苗只适合对付那些已经流传了很久的老传染病,没办法应对像新冠这样的突发新型传染病。
不过,大家千万不要因此而小看了人类智慧的力量。在各国科学家们的努力下,最近出现了好几种全新的疫苗技术,有望在不远的将来彻底解决这个问题。
蛋白质疫苗与核酸疫苗
2020年3月16日,一位名叫詹妮弗·海勒(Jennifer Haller)的西雅图居民在左臂上接受了一针注射,正式开启了新冠疫苗的人体试验。第二天,一批来自武汉的志愿者也接受了新冠疫苗人体注射。此时距离研究人员正式开始疫苗研发仅仅过去了63天,创下了人类疫苗研发史上的最快纪录。
这个惊人的纪录是如何被创造出来的呢?答案就是技术创新。老一代疫苗大都是基于蛋白质的,操作复杂,研发速度缓慢。新一代疫苗则大都是基于核酸的,研发速度比蛋白质快了好几个数量级,上面这两个案例就是如此。
写到这里必须指出,核酸本身不能诱发免疫反应,是不能单独作为抗原使用的,所以任何疫苗归根到底都是蛋白质(外加少量多糖分子)。区别在于,老一代疫苗是在体外生产抗原蛋白质,然后引入人体,新一代疫苗则是把编码蛋白质的基因(其实就是核酸)引入人体,让人体细胞自己合成这个抗原蛋白,诱导免疫反应。
对于外行来说,这两种方法没啥区别,前者似乎还更可控一些。但对于专业人士来说,两种方法天差地别,因为人类已经掌握了很多种操控核酸的技术手段,但操控蛋白质就不那么得心应手了。
可以用大家熟悉的电影做个类比:蛋白质相当于胶片电影,核酸相当于数码电影,虽然最终结果都差不多,但前者剪辑起来非常麻烦,而且很多特效都只能实拍,耗时相当长;后者只需在电脑上移动几下鼠标就可以随心所欲地修改影像或者加特效了,无论是拍摄速度还是创作空间都要比前者提升了不少。
事实上,新一代疫苗专家们还真就是这么做的。今年1月10日,中国科学家率先测出了新冠病毒的基因组全序列,并向全世界公布了测序结果。得知这一消息后,美国国家过敏与传染病研究所(NIAID)的疫苗专家巴尼·格拉姆(Barney Graham)博士立刻打开电脑,开始进行各种复杂计算。3天后,一种针对新冠病毒的最佳抗原靶点序列便被公布了出来。
这一步之所以进行得如此之快,一个很大原因就在于新冠病毒的基因组和SARS(以及MERS)有80%~90%的相同之处,而格拉姆博士此前研究过SARS和MERS疫苗,对这一类冠状病毒的免疫特征有很深的了解,这才很快锁定了病毒表面的刺突蛋白(Spike Protein)作为抗原靶点。
拿到抗原蛋白质的编码序列后,一家总部位于美国波士顿的Moderna生物技术公司立即开动了自己的计算机,很快就设计出了一个代号为mRNA-1273的新冠疫苗。2月24日,首批用于临床试验的mRNA-1273疫苗就生产出来了。3月4日,美国FDA批准了Moderna公司提交的人体试验申请。12天后,第一针疫苗便注射进了包括海勒女士在内的45名志愿者体内。
上述步骤几乎都是在电脑上完成的,科学家们不用直接和病毒打交道,自然也就无需专门建造密闭性能良好的病毒实验室,也不必费心培养宿主细胞。疫苗是在Moderna公司自建的工厂里生产出来的,过程同样非常简单,既不需要培养病毒,也不需要通过基因重组的方式制造工程菌,再上发酵罐。另外,这个疫苗本质上就是一张图纸而已,所以需求量非常小。此前已有动物研究显示,类似疫苗每份只需含有1微克核酸就足够了,所以疫苗工厂只需生产出1克核酸分子,理论上就可以让100万人获得免疫。
新一代疫苗为什么这么厉害呢?这就要从核酸开始讲起了。核酸包括DNA和RNA两种,前者相当于编码蛋白质的原始设计图纸,一直藏在细胞核里,后者当中的“信使RNA”(mRNA)则相当于指导蛋白质合成的施工图纸。信息从原始设计图(DNA)复制到施工图(mRNA)上的过程被称为“转录”(Transcription),这一步是发生在细胞核内的。蛋白质的生产车间设在细胞核外的核糖体内,我们体内的蛋白质都是按照施工图纸(mRNA)上携带的信息,在核糖体内生产出来的,这个过程被称为“翻译”(Translation)。
如果你想让人体细胞生产某种特定的蛋白质,有两个办法:要么把编码这个蛋白质的DNA片段送进细胞,在细胞核内完成“转录”这一步,并释放出相应的mRNA;要么直接把编码蛋白质的mRNA片段送进细胞,指导核糖体完成蛋白质的“翻译”工作。两种办法的区别就在于前者步骤较多,出问题的概率也更大,但DNA比RNA更稳定,所以后者的技术难度比前者高。
无论你用哪一种办法,都必须保证核酸分子在进入细胞之前不被降解,不引发免疫炎症反应,以及进入细胞后能够稳定而又高效地“翻译”出蛋白质。各家生物技术公司比拼的主要就是这几个技术难点,谁解决得好,谁就获得了竞争优势。
就拿前文提到的武汉人体试验来说吧,那款疫苗是由军事医学研究院陈薇院士领衔的团队和天津康希诺生物公司联合开发的Ad5-nCoV疫苗,其核心是一种编码新冠抗原的DNA片段。科学家们用经过改造的人类腺病毒(Adenovirus)作为载体,把这个DNA疫苗送入体内。腺病毒是一种很常见的双链DNA病毒,具备很强的感染人体细胞的能力。科学家们利用了腺病毒的这一特殊能力,把编码新冠抗原的DNA序列通过基因重组的方式整合进了腺病毒的基因组内,同时把负责腺病毒繁殖的基因去掉,使得这个腺病毒载体既可以完成“送信”的任务,又不会导致被接种者生病。
相比之下,西雅图人体试验用的是mRNA疫苗,这种疫苗直接作用于核糖体,易控制,见效快,但RNA分子极不稳定,又很容易被免疫系统当成病毒而遭到攻击,“送信”的难度非常大。Moderna是最早解决了这个问题的公司,或者更准确地说,这家公司就是因为解决了这个问题而成立的。公司成立初期,他们采用的策略是把mRNA分子中的尿嘧啶改为假尿嘧啶,并将这个分子装进一个脂质纳米球内,从而躲过免疫系统的攻击。他们还对mRNA分子的三维结构进行了优化,使得这张“施工图纸”在到达生产车间后能非常高效地被“翻译”成最终产品,也就是抗原蛋白。
因为知识产权保护的原因,这款mRNA-1273疫苗到底采取了哪些更加先进的技术,外人暂时不得而知。

1973年,位于布基纳法索的萨赫勒地区的居民在接种霍乱病毒疫苗
万能疫苗平台
读到这里,也许已经有读者看出,Moderna公司的这项技术不仅可以用来生产抗原蛋白,还可以用来生产任何具有治疗功能的蛋白质。换句话说,这项技术有潜力成为新一代“万能”基因疗法。事实上,这就是Moderna公司成立的初衷,也是投资者们之所以看好他们的最大原因。虽然这家公司一直非常低调,成立10年来只发表过一篇论文,但因为这项技术的优越性非常明显,2018年公司上市时创下了美股历史上最大的生物科技公司IPO纪录。这件事让很多人把这家公司和传奇的基因泰克(Genentech)公司相提并论,后者是第一个把基因重组技术商业化的公司,被公认为是当今所有生物技术公司的鼻祖。
据不完全统计,迄今为止Moderna公司获得的投资总额已经超过了20亿美元,如此雄厚的家底可以允许他们四处出击,在癌症、心血管疾病和新陈代谢疾病等诸多领域进行大胆尝试。不过,从目前情况来看,疫苗很可能是Moderna公司最先获得成功的领域,一个很大原因就在于疫苗蛋白只要多到足以刺激免疫系统产生反应就可以了,对蛋白质产量的调控可以不必做到十分精细,技术难度相对较低。
事实上,Moderna公司很早就在疫苗领域发力了,新冠疫情出现之前已经有8种预防性疫苗进入了I期临床试验,其中一款针对巨细胞病毒的疫苗甚至已经开始了II期临床试验。这家公司试图通过这些临床试验打造一个万能疫苗平台,以后无论出现何种新型传染病,都可以在这个平台上迅速设计出针对性的疫苗,大大提高了疫苗研发的速度。比如新冠疫苗之所以那么快就开始了I期临床试验,一个主要原因就在于mRNA-1273跳过了动物试验这一步。要知道,I期临床的主要目的就是看看疫苗有没有毒性,而Moderna此前已经对他们的疫苗输送系统进行过多次动物试验,这个问题已经被永久地解决了。
康希诺生物公司的Ad5-nCoV疫苗之所以那么快就可以开始I期临床试验,原因也在这里。这家公司此前已经和军事医学研究院陈薇团队合作研发了一款埃博拉疫苗,用的是同一种腺病毒载体,技术上也已经相当成熟了。
换句话说,上面这两家公司之所以领先其他公司,原因就在于他们都各自搭建了一个万能疫苗平台,只有这样才能加快疫苗研发速度,争取赶上病毒的脚步。
这两家公司分别代表了两种不同的技术路线,各有千秋。一般认为,腺病毒载体疫苗的优点是已经有成功案例,可以作为后续疫苗的参照。缺点是载体毕竟是病毒,有潜在的感染风险,此前感染过腺病毒的人有可能形成了免疫力,从而对疫苗载体发起攻击。另外,疫苗DNA有可能被整合到宿主的DNA上,这是任何人都不愿意看到的结果。不过,军事医学研究院负责Ad5-nCoV疫苗项目的侯利华博士对本刊记者解释说,腺病毒载体进入到临床试验已有20多年了,还未发现过跟人体基因整合的现象,在细胞和动物水平也没有发现过。他们这次用的载体是复制缺陷型的,并不会在人体细胞内复制,因此也没有腺病毒感染风险。
相比之下,mRNA疫苗的优点是反应速度快,蛋白质合成终结得也快,无需担心疫苗长久滞留在人体内,也没有感染风险。缺点是迄今为止尚无成功案例,甚至连一个进入过II期临床试验的都没有,没人知道这个技术路线前景如何。
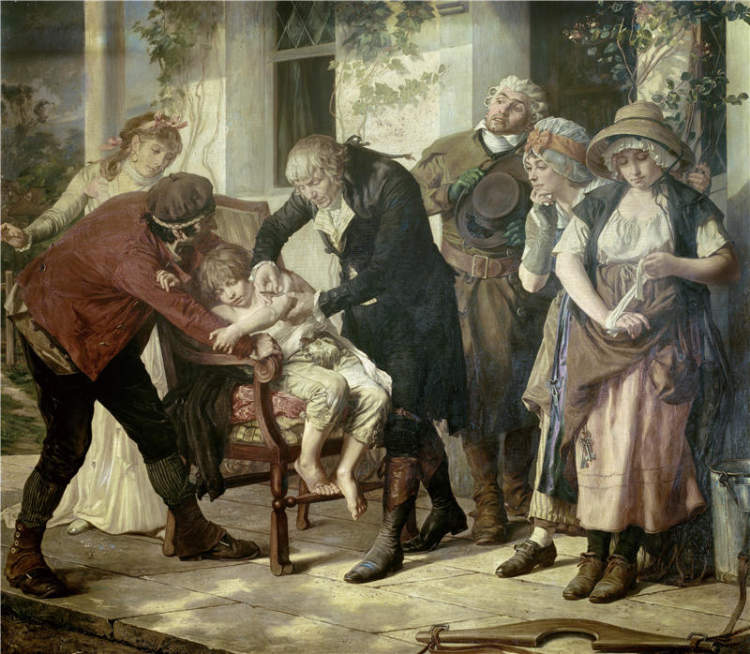
1796年,英国医生爱德华 · 詹纳给孩子接种牛痘疫苗的场景被绘画下来
正因为如此,采取这一路线的制药公司承担的风险要大一些。于是,一家名为“流行病防范创新联盟”(CEPI)的公益机构伸出援手,承担了Moderna公司西雅图人体试验的费用。这家总部设在挪威首都奥斯陆的慈善机构成立于2017年,起因就是一些有识之士看到了埃博拉疫情期间私人企业因为怕亏本而不愿全心投入疫苗研发,导致这场疫情持续了4年之久,造成了1.1万人死亡,直接经济损失高达539亿美元。于是,他们决定成立CEPI,向全世界募集资金,帮助科研机构和制药企业分担风险,加快预防性疫苗的研发速度,防止未来可能出现的新型传染病。
根据CEPI为本刊记者提供的资料,该机构获得了包括梅琳达·盖茨基金会、维康信托基金会(Wellcome Trust)、欧盟,以及多国政府提供的捐款,总额达到了7.6亿美元。迄今为止该机构已经为新冠疫苗开发提供了2920万美元研发经费,资助了包括Moderna在内的8个研究机构,涉及到好几个不同的疫苗研发技术平台。该机构负责人表示,这么做是为了分散风险,避免把所有鸡蛋都放在同一个篮子里。
据CEPI估计,为了保证新冠疫苗能在12~18个月内开发出来,并让广大民众都能用上,至少需要再投资20亿美元。这是一项艰巨的任务,需要各方一起努力。
除了CEPI资助的这8家机构之外,还有很多制药企业也在努力。根据世界卫生组织(WHO)的统计,目前至少有52种不同的新冠疫苗处于研发阶段,它们可以按照平台的不同分成灭活病毒、减活病毒、重组病毒蛋白、RNA疫苗、DNA疫苗、非复制性载体、复制性载体和病毒样粒子(去掉基因的病毒外壳)八大类。大家互相竞争,看谁最先取得突破。
这些机构当中,除了上文提到的Moderna公司的mRNA-1273疫苗(属于RNA类),以及康希诺公司的Ad5-nCoV疫苗(属于非复制性载体类)之外,还有一家企业值得一提,这就是总部位于德国的BioNtech生物技术公司。就在Moderna开始全球首例人体试验的当天,BioNtech和复星医药公司宣布签署合作协议,共同开发代号为BNT162序列的mRNA疫苗。负责该项目的复星医药公司全球研发总裁和首席医学官回爱民博士告诉本刊记者,这几款疫苗是BioNtech公司利用其多元化的mRNA平台开发出来的几种多构型疫苗,包括脲苷mRNA、核苷修饰mRNA以及自扩增mRNA疫苗等。几种不同构型的mRNA疫苗各有千秋,公司会同时推进并择优筛选,力争提高成功率。
另据回爱民博士透露,BioNtech公司和复星医药合作的mRNA疫苗计划在4月下半月首先在德国开始临床试验。在中国,根据国家的合规程序正在和有关部门探讨,希望能尽快开始临床试验。如果一切顺利的话,今年秋季有望开始III期临床试验。
看上去似乎一切都好,曙光就在前面。但是,疫苗研发只是万里长征的第一步,更麻烦的事情还在后面。

3月26日,巴西一名驾车经过里约热内卢的司机在接种疫苗,这种疫苗对新冠肺炎无效,但是对多数别的传染病有效
临床试验的保守与创新
按照常规,疫苗的人体试验分为3期。I期人数极少,重点考察疫苗的安全性,并确定安全剂量。II期人数稍多,重点考察疫苗能否顺利诱导出抗体。III期人数最多,重点考察疫苗是否管用。只有III期临床试验通过之后才能向FDA申请上市,被批准后方能投入生产。
这其中,III期临床试验耗时最多,因为这是大规模人体试验,需要招募数千甚至上万名志愿者,将其分成两组,一组接种一组对照,然后让他们回到各自的日常生活中去,过一段时间后统计两组志愿者的感染情况,看看有何差别。根据疫情的严重程度,这段等待时间短则数月,长则数年。如果时间太短,大部分志愿者都还没机会被感染,试验数据是没法用的。
显然,目前的新冠疫情很难允许制药厂等待那么长的时间。正是在这种情况下,上周二出版的国际知名期刊《传染病杂志》(Journal of Infectious Diseases)发表了一篇论文,提出“人体感染试验”(Human Challenge Studies)也许是个更好的办法。
顾名思义,人体感染试验指的是让志愿者直接感染病毒,通过这个办法来判断疫苗是否有效。“初听起来,这个办法相当不符合医学伦理,其实类似做法在很多不那么致命的传染病当中已经尝试过很多次了,像流感、霍乱、伤寒和疟疾等传染病此前都曾经有人以身试毒,这个做法并不罕见。”论文第一作者、美国罗格斯大学(Rutgers University)生命伦理学研究中心主任尼尔·伊亚尔(Nir Eyal)博士解释说:“根据新冠的特征,如果我们合理地设计人体感染试验的流程,其危险性对于受试者来说是非常低的,甚至有可能比他们不参加试验还要低。”
按照伊亚尔博士的设想,候选疫苗首先应该完成动物试验和I期、II期临床试验,确定它本身是安全的,并且可以刺激受试者产生相应的抗体。之后,研发机构可以从疫情比较严重的地区挑选一批年龄在20~45岁的健康人,为他们接种疫苗。两周后,将这批人分成两组,一组感染活病毒,一组对照,密切观察他们的身体状况,一旦出现问题就立即送医。
“如果志愿者是从疫情高发区挑选出来的,那么他们即使不来当志愿者,早晚也会被感染,所以我估计很多人会通过理智的思考,得出结论说自己来当志愿者反而更加安全,因为这么做可以获得更好的医疗照顾。”伊亚尔博士继续解释他的设想,“当然了,不排除一些人是为了人道主义精神而主动要求当志愿者的,这样的人自然也欢迎,但我不建议研发机构出高价征集志愿者,这么做会让这项试验失去公信力。”
说到公信力,有人担心如果政策允许人体感染试验,很可能会被一些不良企业滥用,去穷国招募受试者。为此伊亚尔博士解释说,所有药企都希望自己生产的疫苗卖到其他国家去,这就要求他们必须将研发过程写成论文,发表在国际知名期刊上,接受全世界的监督。如果该企业在研发过程中有任何违反人权的做法,肯定会被发现并被抵制。
读到这里也许有人会问,受试者体内出现抗体不就意味着疫苗成功了吗?很多其他传染病的免疫计划就是依照抗体检测的结果来决定是否补针的,为什么新冠疫苗不行呢?针对这个疑问,上篇论文的另一位作者、英国伦敦卫生与热带医学研究院(London School of Hygiene & Tropical Medicine)传染病学教授彼得·史密斯(Peter Smith)博士对本刊记者解释说,一些已经被研究得很透彻的老传染病确实可以通过抗体来判断免疫力的有无,但新冠是一种新型传染病,我们并不知道光有抗体行不行,以及抗体需要达到何种强度才管用。动物试验虽然能帮助我们进一步了解这种病毒,但是否能直接用到人类身上也很难说,比如当年在开发埃博拉疫苗时就发现灵长类试验动物对于疫苗的反应要好于人类。所以他本人坚信,新冠疫苗大概率必须通过真正的III期临床试验的检验才能获得批准。
“不过呢,现在是非常时期,什么事情都有可能发生。”史密斯教授补充道,“中国当年就曾经仅仅根据动物试验结果,以及人类的抗体反应而批准了一款埃博拉疫苗。”
这篇论文发表后,一些科学家表示了赞同。曾经研发出风疹疫苗的美国宾夕法尼亚大学教授斯坦利·普罗金(Stanley Plotkin)指出,精心设计的人体感染试验能够把III期临床试验的时间缩短到2~3个月,在这个非常时期,我们应该放弃自己的偏见,勇于尝试新方法。
但是,也有不少人反对这个做法,比如回爱民博士就表示,复星医药不会考虑人体感染试验,依然会采用传统方式来验证疫苗的效果。曾经在NIAID主持过流感疫苗人体感染试验的美国免疫学家马修·米莫里(Matthew Memoli)博士则认为,流感是一种已经被研究得很透彻的传染病,所以可以这么做。但像新冠这样的新型传染病,我们并不知道有多大概率会让感染者得重病,也不知道病人是否会留下后遗症,还是谨慎一点儿好。
问题在于,正是因为我们对流感很熟悉,知道如何对付它,才不那么着急。可对于新冠来说,起码在目前的情况下,疫苗晚一天被批准,就意味着上千人因此而死亡。所以归根到底,这个问题取决于我们是否愿意牺牲少数人的利益以换取多数人的健康,以及少数人利益到底牺牲到何种程度,才不违反人道主义精神。
时间不等人,希望各位专家们尽快讨论出一个结果,好让老百姓尽早接种新冠疫苗,恢复正常生活。
结语
即使临床试验完成了,疫苗被批准了,事情还没完。因为我们必须保证让所有人都能用上,而不仅仅是只有少数特权阶层或者发达国家居民才能获得免疫,这就涉及到如何提高疫苗产能,如何分配,以及如何定价的问题。不过,也有人认为,即使一开始产能不足也没关系,如果能先把医护人员和老弱病残保护起来,便已功德无量了。
接下来还有一个问题亟待解决,那就是疫苗究竟能保护我们多久?已有研究显示,SARS疫苗和MERS疫苗不能带来长久的保护,几年之后体内就不再有抗体了。不过,即便如此,如果某种疫苗能够保护我们几年,也许就足以打败新冠病毒了。
还有一个可能出现的情况,那就是等到疫苗终于被批准使用了,疫情却已经基本被控制住了,那时普通老百姓是否还愿意(花钱)打这个疫苗呢?要知道,对于疫苗的抵制是一种遍及全世界的普遍现象,很多人连流感疫苗都不愿打,政府是否应该强制他们打新冠疫苗?
不过,更大的问题还在于,即使将来新冠病毒彻底从人类当中消失了,冠状病毒却仍然会继续存活在某种动物体内,永远不会消失。假如未来某一天它们通过基因突变再次获得了入侵人体的能力,我们是不是又要经历一次新冠疫情呢?如果那一天真的到来了,万能疫苗平台能否立即发挥作用呢?
一切都是未知数。
病毒颗粒是死的,但病毒本身却是有生命的,能够像所有其他生命那样不断寻找新的出路,这就是生命的本质,没人能够逃脱。
也许,是时候重新思考一下人类和大自然之间的关系了。疫苗生产得再快,也快不过进化的脚步。
 相关文章
相关文章



 精彩导读
精彩导读







 热门资讯
热门资讯
